परमाणु किसे कहते हैं?
परमाणु (Atom)
किसी तत्व की सबसे छोटी इकाई, जो स्वतंत्र अवस्था में नहीं पायी जाती है बल्कि जो रासायनिक अभिक्रिया में भाग ले सकती है, उसे परमाणु कहते हैं।
परमाणु की खोज
भारतीय दार्शनिक महर्षि कणाद ने लगभग 500 वर्ष ई.पू. प्रतिपादित किया था कि पदार्थ को विभाजि करते जाये तो अन्ततः ऐसे कण प्राप्त होते है जो आगे विभाजित नहीं होते उन्होंने इन अविभाज्य सुक्ष्मतम कणों को परमाणु कहा।
एक अन्य भारतीय दार्शनिक पकुधा कात्यायन ने महर्षि कणाद के मत को विस्तार से समझाते हुए बताया कि यह अविभाज्य सुक्ष्मतम कण स्वतंत्र न रहकर संयुक्त रूप में पाये जाते है तथा पदार्थ के विभिन्न रूप यथा तत्व, यौगिक, मिश्रण आदि का निर्माण करते है।
महर्षि कणाद द्वारा रचित “वैशेषिक दर्शन” में परमाणु सिद्धान्त का उल्लेख है।
ग्रीक दार्शनिक डेमोक्रिटस एवं लियुसीपस अविभाज्य सुक्षमतम कणों “एटमस” नाम दिया जिसका शाब्दिक अर्थ न काटे जाने वाला था। दर्शन शास्त्र पर आधारित इन खोजो का कोई प्रायोगिक आधार नहीं था।
परमाणु संख्या या परमाणु क्रमांक (Z)
किसी परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या परमाणु संख्या अथवा परमाणु क्रमांक कहलाता हैं।
जैसे :-
कार्बन C के लिए Z = 6 क्योंकि C में 6 प्रोटॉन होते है।
हाइड्रोजन परमाणु (H) के लिए Z=1 है क्योंकि हाइड्रोजन के नाभिक में केवल एक प्रोटॉन होता है।
एक परमाणु के नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन की कुल संख्या के योग को द्रव्यमान संख्या कहते हैं।
यह सदैव एक पूर्णक संख्या होती हैं।
A = Z+n
परमाणु के भौतिक कण
परमाणु में तीन प्रकार के भौतिक कण पाये जाते है – इलेक्ट्रान, प्रोटॉन एवं न्यूट्रॉन
डाल्टन का परमाणु सिद्धांत
डाल्टन के अनुसार परमाणु का न तो निर्माण किया जा सकता है और न विनाश। परमाणु का विभाजन भी नहीं किया जा सकता है, लेकिन आज ये सब संभव है।
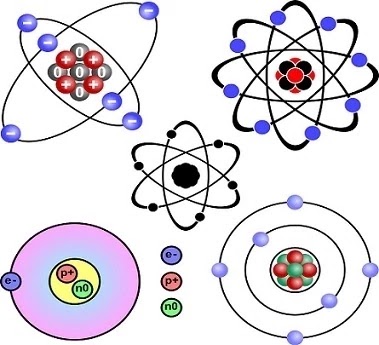
थॉमसन की परमाणु संरचना
जे. जे. थॉमसन के अनुसार परमाणु एक धनावेशित गोला है, जिसमें ऋणावेशित कण इस प्रकार से व्यवस्थित रहते हैं कि पूरा परमाणु उदासीन हो जाता है।
रदरफोर्ड की परमाणु संरचना
रदरफोर्ड के अनुसार परमाणु का एक नाभिक (Nucleus) होता है, जिसमें परमाणु का कुल द्रव्यमान तथा कुल धनावेश केन्द्रित रहता है। ऋणावेशित कण, इलेक्ट्रॉन नाभिक के चारों ओर विभिन्न कक्षाओं में घूमते रहते हैं। नाभिक का आयतन परमाणु के आयतन की अपेक्षा नगण्य होता है।
परमाणु की त्रिज्या 10-10 मीटर तथा नाभिक की त्रिज्या 10-15 मीटर के लगभग होती है।
परमाणु का नाभिक
- परमाणु का केन्द्र, जिसमें परमाणु का सम्पूर्ण द्रव्यमान तथा सम्पूर्ण धनावेश केन्द्रित रहता है, परमाणु का नाभिक कहलाता है।
- इसमें दो प्रकार के कण पाये जाते हैं- न्यूट्रॉन तथा प्रोटॉन न्यूट्रॉन आवेशहीन होता है, पर प्रोट्रॉन पर +1 इकाई धन आवेश होता है।
- प्रोटॉन तथा न्यूट्रॉन को मिलाकर न्यूक्लियोन (Nucleons) कहते हैं।
- सभी न्यूक्लियोन के बीच एक आकर्षण बल उत्पन्न होते हैं, जिसे नाभिकीय बल कहते हैं। इसी बल के कारण परमाणु का नाभिक में स्थायित्व होता है।
- नाभिक में होने वाले अभिक्रिया को नाभिकीय अभिक्रिया कहते हैं, जो दो प्रकार के होते हैं- नाभिकीय विखंडन तथा नाभिकीय संलयन
- हाइड्रोजन के प्रोटियम (H) समस्थानिक के नाभिक में कोई न्यूट्रॉन नहीं होता है।
कक्षा (Orbit) - परमाणु के नाभिक के चारों ओर इलेक्ट्रॉन विभिन्न वृत्तीय पथों में घूमते रहते हैं। इन वृत्तीय पथों को कक्षा या सेल (Shell) या ऊर्जा स्तर कहते हैं।
- इन्हें K, L, M, N इत्यादि से निर्देशित किया जाता है।
- किसी कक्षा में इलेक्ट्रॉन की अधिकतम संख्या 2n2 में होती है, जहाँ n कक्षा संख्या है।
जैसे
|
कक्षा |
इलेक्ट्रॉन की संख्या |
|
K |
2
x 12 = 2 |
|
L |
2
x 22 = 8 |
|
M |
2
x 32 = 18 |
|
N |
2
x 42 = 32 |
- किसी परमाणु की अंतिम कक्षा में इलेक्ट्रॉन की अधिकतम संख्या 8 होती है।
- किसी परमाणु की अंतिम कक्षा के पहले वाली कक्षा को पेनल्टिमेट कक्षा (Penultimate orbit) तथा पेनेल्टिमेट कक्षा के पहले वाली कक्षा को एन्टीपेनल्टिमेट कक्षा (Antepenultimate Orbit) कहते हैं।
उपकक्षा (Sub-orbit) - एक कक्षा के विभिन्न भाग होते हैं। इन भागों को उपकक्षा कहते हैं। इन्हें s.p.d.f इत्यादि द्वारा सूचित किया जाता है।
- K- कक्षा में एक उपकक्षा होता है-
- L- कक्षा में दो उपकक्षा होते हैं- s और p
- M- कक्षा में तीन उपक्षा होते हैं- s, p और d
- N- कक्षा में चार उपकक्षा होते हैं- s, p, d और f
इलेक्ट्रॉन की अधिकतम संख्या s-उपकक्षा में 2, p-उपकक्षा में 6,d- उपकक्षा में 10 तथा f-उपकक्षा में 14 होती है।

Hii
ReplyDeleteजी सर हम आपकी क्या मदत कर सकते है? अपने प्रश्न कीजिये.
Delete